As fissuras labiopalatais representam a anomalia congênita mais frequente na face, e as múltiplas alterações anatômicas envolvidas despertam interesse científico e enfoque terapêutico multidisciplinar1.
Essas malformações acometem o terço médio da face, sendo ocasionadas pela não fusão dos processos nasais e maxilares, durante a sexta e a décima semana de vida intrauterina2.
Com relação à etiologia, fatores genéticos e ou ambientais podem estar envolvidos. A grande maioria dos casos (70%) é atribuída a fatores ambientais que atingem a mãe no primeiro trimestre da gestação. Esses casos portanto são passíveis de prevenção. Os mais comuns são: anemia e nutrição deficiente, uso de drogas, cigarro, alguns medicamentos e bebidas alcoólicas. Nos outros 30% dos casos, as deformidades são devidas à transmissão genética. Na presença de uma predisposição genética, fatores ambientais podem precipitar o surgimento da patologia.

As fissuras labiais ou labiopalatais são etiologicamente distintas das fissuras palatais isoladas, sendo essas mais frequentemente associadas a quadros sindrômicos do que as primeiras.
Estudos epidemiológicos têm sido realizados em todo o mundo, e têm mostrado que a prevalência de fissuras labiopalatais varia muito em relação aos países, sendo de apenas 1,07%, no Japão, e de 4,3%, em Taiwan3,4. No Brasil, estudos recentes apontam que a sua ocorrência seja de uma para cada 650 indivíduos nascidos vivos.
Como o diagnóstico pode ser feito através do exame de ultrassonografia morfológica, é de extrema importância o encaminhamento da gestante para os Centros de Tratamento especializados, para que possam receber a orientação precoce sobre a patologia e o tratamento.
O CEFIL – Centro de Tratamento de Fissuras Labiopalatais, é um serviço do Hospital Nossa Senhora do Loreto, que foi criado oficialmente no ano de 1985 e credenciado pelo Ministério da Saúde em Dezembro de 2000 para o atendimento da alta complexidade.
É composto por uma equipe multidisciplinar, especializada no tratamento das fendas labiopalatais e suas implicações estéticas, funcionais e psicológicas. A equipe é composta por profissionais de várias especialidades, sendo o tripé fundamental para o tratamento as clínicas de cirurgia-plástica, odontologia e fonoaudiologia. Conta ainda com várias outras especialidades e serviços, que dão suporte no atendimento ao portador de fenda: Pediatria, Genética médica, Nutrição, Terapia ocupacional, Fisioterapia, Terapia Alternativa, Dermatologia, Hematologia, Saúde Mental (Psicologia), Anestesiologia, Cirurgia Pediátrica, Otorrinolaringologia, Cardiologia, Audiologia, Enfermagem e Serviço Social.
A criança portadora de fenda labiopalatal apresenta logo ao nascimento pequenas diferenciações em seu trato, que exigem orientação especializada aos pais e à equipe médica.
Logo ao nascimento, e após o diagnóstico positivo de fenda, o aleitamento materno deve ser estimulado no Hospital de origem, antes de se proceder a sondagem. Caso não seja possível, o indicado é coletar o leite materno e oferecê-lo em mamadeira com o paciente na posição vertical, evitando assim regurgitações e aspirações.
Se a sucção nutritiva não puder ser estabelecida, deverá ser então introduzida a sonda para as primeiras alimentações e estimulada a sucção não nutritiva. A partir de então, deverá ser encaminhado ao CEFIL para os procedimentos específicos.
Todos os bebês recém–natos deverão vir acompanhados de enfermagem e médico pediatra.
Um estudo retrospectivo foi realizado para identificar todos os pacientes com diagnóstico de fissura labial, palatal ou labiopalatal que foram atendidos pela primeira vez no CEFIL no período de julho de 2008 a janeiro de 2012.
As variáveis estudadas foram a idade do paciente na primeira consulta, sexo, tipo de fissura, história familiar de fissura e parentesco, intercorrências durante o primeiro trimestre de gestação, o uso de álcool, drogas, fumo, anemia, vômitos, perda de peso, vacinação para rubéola, uso de medicamentos, idade da mãe ao engravidar, patologias da mãe, realização de pré-natal e prematuridade.
Uma amostra de 526 crianças foi selecionada e as deformidades foram categorizadas baseando-se na classificação de Spina, tendo como ponto de referência o forame incisivo.
O resultado do estudo determinou que a fissura palatal isolada ocorre em 40,3% dos casos. As fissuras labiais isoladas encontradas em 23,8% dos casos, sendo unilateral em 19,4%, bilateral 3% e mediana em 0,8%. As fissuras labiopalatais corresponderam a 35,9%, sendo bilateral em 10,9% dos casos e unilateral em 25%.
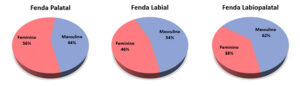
A prevalência da fissura palatal isolada por sexo foi de 44% de homens e 56% de mulheres. A fissura labial apresentou 54% de homens e 46% de mulheres. E a fissura labiopalatal 62% de homens e 38% de mulheres.
Variáveis com ocorrência no primeiro trimestre da gestação apresentaram a seguinte prevalência: vômitos presente em 41% dos casos, anemia em 38%, uso de drogas em 4,8%, álcool em 23%, remédios 5%, tentativa de aborto 3,5%, vacinação para rubéola 11%, fumo em 15,7% e perda de peso em 31% dos casos.
Antecedentes familiares de fissura labiopalatal presentes em 27% das fissuras, sendo 32% nas fissuras labiopalatais, 24% na palatal e 22% na labial, o parentesco materno presente em 40,3%, paterno em 42,4% e em ambos 17,4%.
As patologias associadas aos pacientes fissurados estiveram presentes em 16% dos casos, sendo que na fissura palatal isolada 23%, labial 12% e labiopalatal 11%.
Prematuridade presente em 13% dos casos. Doenças da mãe em 21%, problemas gestacionais 32%. Pré-natal realizado em 97% dos casos.
A idade do paciente na primeira consulta no CEFIL foi em 77% dos casos inferior a 6 meses, de 6 meses a 1 ano 8%, entre 1 e 5 anos foi de 4,4%, entre 5 a 15 de 7,5%e maiores de 15 anos 2%.
A idade da mãe variou de 10 a 43 anos, sendo que menores de 15 anos representaram 5,6%, de 15 a 20 anos 19,3%, de 20 a 35 anos 64,6% e maiores de 35 anos 10,5%.
Os achados servem como parâmetro para levantar questões sobre como estão sendo tratados os referidos fissurados, bem como mensurar uma realidade local. Os resultados encontrados foram de acordo com a literatura mundial que considera que fatores genéticos e ambientais estejam envolvidos na gênese da fissura e corroboram que as fissuras labiopalatais e labiais são entidades distintas das fissuras palatais.
Participaram também como autores:
- Cruz, Ana Cláudia (Ortodontista – Coordenadora do CEFIL – HMNSLoreto);
- Esposito, Ana Carolina (Médica Geneticista – HMNSLoreto);
- Rechia, Giancarlo (Cirurgião plástico);
- Zanini, Luiz Sérgio (C. Plástico – Chefe da C. Plástica – HMNS Loreto).
Fonte: Site da Soperj
REFERÊNCIAS
- Mélega, JM. Cirurgia Plástica Fundamentos e Arte – Cirurgia Reparadora de Cabeça e Pescoço, 1 ed, São Paulo: MEDSI,2002.
- Carreirão S, Lessa S, Zanini AS. Embriologia da face. In: Tratamento das fissuras labiopalatais. 2ª ed. Rio de Janeiro: Revinter; 1996. p.1-12.
- Souza JMP, Buchalla CM, Laurenti R. Estudo da morbidade e da mortalidade perinatal em maternidades. III. Anomalias congênitas em nascidos vivos. Rev Saúde Pública. 1987;21:5-12.
- Nagem Filho H, Moraes N, Rocha RGF. Contribuição para o estudo da prevalência das más formações congênitas labiopalatais na população escolar de Bauru. Rev Fac Odontol São Paulo. 1968;6:111-28.







